Konfigurasi Elektron Bohr

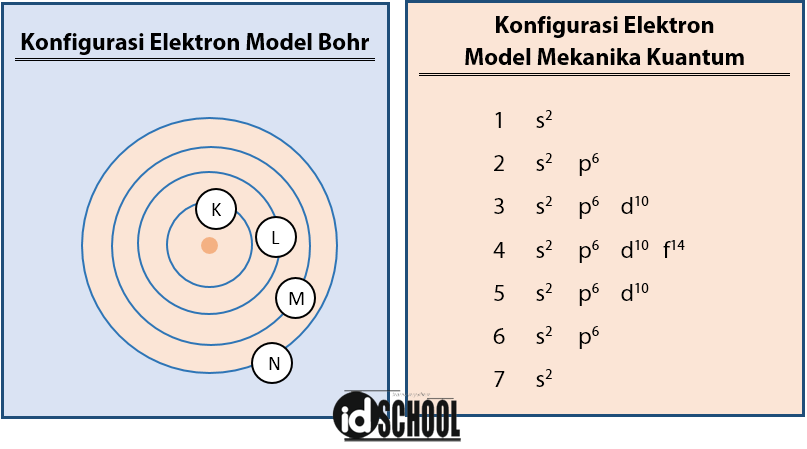
Hal yang memdasarikonfigurasielektron adalah model atom bohr yang digunakan untuk menjabarkan kulit dan subkulit.
Konfigurasi elektron bohr. Konfigurasi elektron berfungsi untuk menjelaskan konsepikatan kimia sifat laser semikonduktor dan membantu memahami struktur pada tabel periodik. Konfigurasi elektron yang pertama kali dipikirkan adalah berdasarkan pada model atom model bohr adalah umum membicarakan kelopak maupun subkelopak walaupun sudah terdapat kemajuan dalam pemahaman sifat sifat mekanika kuantum elektron. Konfigurasi elektron ialah penyusunan atau pengaturan elektron berdasarkan tingkat energinya dalam suatu atom. Macam macam konfigurasi elektron.
Dalam setiap atom telah tersedia orbital orbital akan tetapi belum tentu semua orbital ini terisi penuh. Pengisian elektron dalam orbital orbital memenuhi beberapa peraturan antara lain. Tingkat energi kedua diberi lambang l ketiga m dan seterusnya. Konfigurasi elektron adalah susunan penyebaran pengisian elektron elektron dalam.
Jumlah maksimum elektron yang dapat ditampung oleh masing masing kulit mengikuti persamaan berikut. Berdasarkan asas larangan pauli sebuah orbital hanya dapat menampung maksimal dua elektron namun pada kasus kasus tertentu terdapat beberapa orbital yang. Kemudian jika kulit pertama kulit k sudah terisi penuh elektron kemudian mengisi kulit tingkat berikutnya yaitu kulit l kulit ke dua n 2 kulit m kulit ke tiga n 3. Konfigurasi elektron model atom niels bohr semankin besar nomor kulit akan semakin besar pula ruang cakupannya untuk menampung elektron.
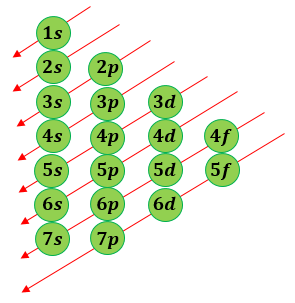
Konfigurasi elektron juga memiliki beberapa macam. Konfigurasi elektron model mekanika kuantum berdasarkan asas aufbau. Konfigurasi elektron model bohr. Sama seperti partikel elementer lainnya elektron juga harus patuh pada hukum mekanika kuantum dan menampilkan sifat sifat bak partikel maupun bak gelombang.
Ne 3s 2 3p 3. Konfigurasi elektron model mekanika kuantum berdasarkan asas aufbau. Elektron elektron mulai mengisi orbital dengan tingkat energi terendah dan seterusnya. Tingkat energi paling dekat dengan inti atau tingkat energi pertama n 1 diberi lambang k atau disebut kulit k.
Seperti yang telah dibahas dalam bab struktur atom di dalam atom terdapat partikel subatomik neutron dan proton yang terdapat pada inti atom dan elektron yang bergerak mengelilingi inti atom tersebut pada kulit kulit elektron level level energi yang tertentu. Pengajuannya didasarkan pada model atom. Konfigurasi elektron model atom bohr merupakan pengisian elektron yang dimulai dari tingkat energi kulit yang paling rendah yaitu kulit k kulit pertama n 1. Konfigurasi elektron model bohr.
1s 2 2s 2 2p 6 3s 2. Sejarah konfigurasi elektron niels bohr adalah orang yang pertama kali 1923 mengajukan bahwa periodisitas pada sifat sifat unsur kimia dapat dijelaskan oleh struktur elektronik atom tersebut. Dengan kata lain jumlah elektron yang dapat berada di kulit l akan lebih besar daripada di kulit k.